INTRODUCCIÓN :
En la presente practica manifestaremos un cambio en la materia, se utiliza una ecuación química que es la forma de representar cómo se altera la naturaleza de los elementos o cómo reacciona uno al contacto con otros. Si deseamos comprender estas alteraciones, debemos ser capaces de equilibrar o balancear las ecuaciones químicas .
Conocer su origen y su procedimiento es muy importante a la hora de asegurar que se cumpla la ley de la conservación de la masa, pero hay más, por que ya conociendo los coeficientes que balancean la ecuación, estos coeficientes te indican las relaciones molares que se guardan entre las sustancias, así tu puedes calcular las cantidades necesarias de las sustancias que van a reaccionar con una cierta cantidad de una de las sustancias (que hayas fijado) y cuánto vas a obtener de los productos o al revés, si deseas obtener una cierta cantidad de alguna sustancia, puedes calcular las cantidades de reactivos que debes utilizar.
OBJETIVOS
- Identificar y aprender a balancear una ecuación química por método de tanteo
-El objetivo de balancear una ecuación química es hacer que cumpla con la Ley de la conservación de la masa la cual establece que en una reacción química la masa de los reactivos debe ser igual a la masa de los productos.
MARCO TEÓRICO
Una reacción química es el proceso en el cual ocurre un cambio químico, las sustancias o elementos iniciales se llaman reactivos y las que resultan del proceso de transformación se les llama productos.
Una reacción química es el proceso en el cual ocurre un cambio químico, las sustancias o elementos iniciales se llaman reactivos y las que resultan del proceso de transformación se les llama productos.

Una Ecuación Química es la representación simbólica de las reacciones.
Cuando se escribe una ecuación se emplean distintos símbolos o fórmulas de compuestos
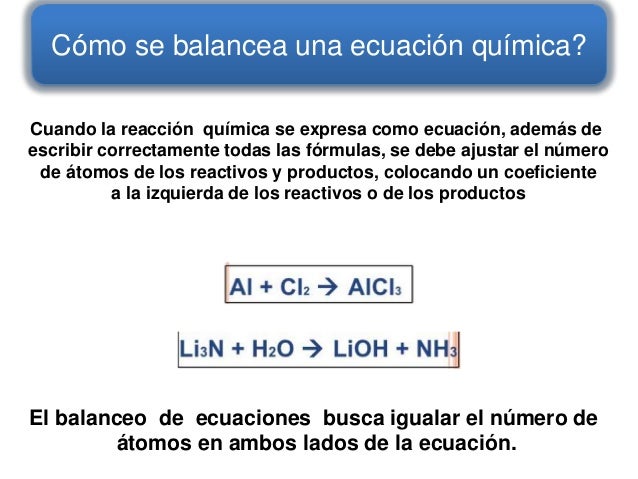
Balanceo de ecuaciones químicas
Una reacción química es la manifestación de un cambio en la materia y la isla de un fenómeno químico. A su expresión gráfica se le da el nombre de ecuación química, en la cual, se expresan en la primera parte los reactivos y en la segunda los productos de la reacción.
A + B C + D
Reactivos Productos
Para equilibrar o balancear ecuaciones químicas, existen diversos métodos. En todos el objetivo que se persigue es que la ecuación química cumpla con la ley de la conservación de la materia.
Balanceo de ecuaciones por el método de Tanteo
El método de tanteo consiste en observar que cada miembro de la ecuación se tengan los átomos en la misma cantidad, recordando que en
H2SO4 hay 2 Hidrogenos 1 Azufre y 4 Oxigenos
5H2SO4 hay 10 Hidrógenos 5 azufres y 20 Oxígenos
Para equilibrar ecuaciones, solo se agregan coeficientes a las formulas que lo necesiten, pero no se cambian los subíndices.
trabajo de balanceo en clase Procedimiento
-Ingresamos a
2. Le podemos dar click a cualquiera de estas dos opciones para poder navegar y aprender a usar el método de tanteo
Empezando por una introducción que es el comienzo a aprender sobre este método y después con los juegos que son actividades de aprendizaje en torno a este método
balanceo del amoniaco
segundo nivel
tercer nivel
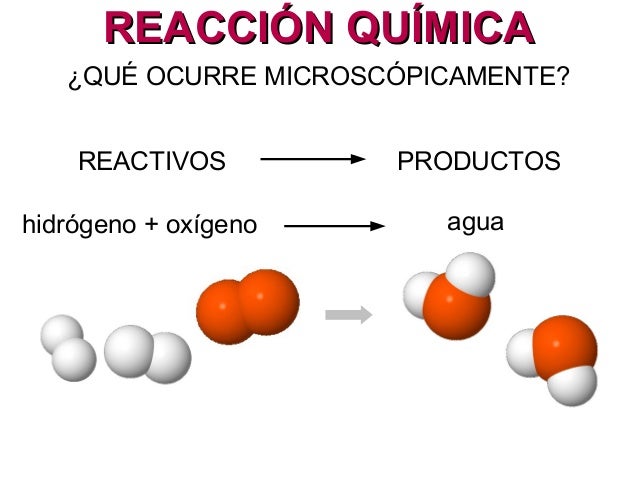
Una ecuación química es una representación simbólica escrita de una reacción química. El o los químicos reactivos figuran al lado izquierdo y el o los químicos que se producen figuran al lado derecho.
La ley de la conservación de la materia afirma que ningún átomo puede crearse o destruirse en una reacción química, así que el número de átomos que están presentes en los reactivos tiene que ser igual al número de átomos presentes en los productos.
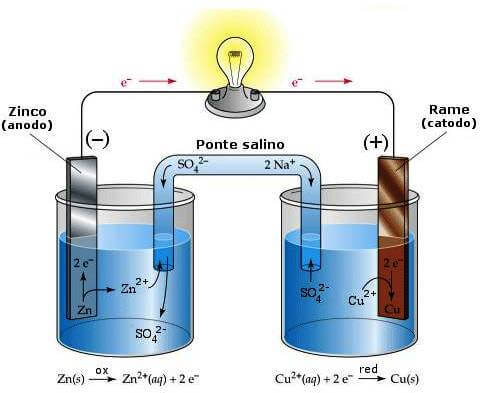
oxido _Reducción
se denomina oxido reducción a toda reacción química en la que uno o más electrones se transfieren entre los reactivos, provocando un cambio en sus estados de oxidación.
1
Para que exista una reacción de reducción e oxidación, en el sistema debe haber un elemento que ceda electrones, y otro que los acepte:
El agente oxidante es aquel elemento químico que tiende a captar esos electrones, quedando con un estado de oxidación inferior al que tenía, es decir, siendo reducido.
El agente reductor Es aquel elemento químico que suministra electrones de su estructura química al medio, aumentando su estado de oxidación, es decir siendo oxidado.
Oxidación
Oxidación del hierro.
La oxidación es una reacción química donde un elemento cede electrones, y por lo tanto aumenta su estado de oxidación.3
Se debe tener en cuenta que en realidad una oxidación o una reducción es un proceso por el cual cambia el estado de oxidación de un compuesto. Este cambio no significa necesariamente un intercambio de iones. Implica que todos los compuestos formados mediante un proceso redox son iónicos, puesto que es en estos compuestos donde sí se da un enlace iónico, producto de la transferencia de electrones.
Reducción
En química, reducción es el proceso electroquímico por el cual un átomo o un ion gana electrones. Implica la disminución de su estado de oxidación. Este proceso es contrario al de oxidación.
Cuando un ion o un átomo se reduce presenta estas características:
Actúa como agente oxidante.
Es reducido por un agente reductor.
Disminuye su estado o número de oxidación.


Para determinar cuando un elemento se oxida o se reduce puede utilizarse la siguiente regla práctica:
Si el elemento cambia su número de oxidación en este sentido SE OXIDA
Para determinar cuando un elemento se oxida o se reduce puede utilizarse la siguiente regla práctica:
Si el elemento cambia su número de oxidación en este sentido SE OXIDA
Si el elemento cambia su número de oxidación en este sentido SE REDUCE.
Así si el Na0 pasa a Na+ perdió un electrón, lo que indica que se oxidó.
Si el Cl0 pasa a Cl- ganó un electrón, lo que indica que se redujo.
Agentes oxidantes: son especies químicas que ganan electrones, se reducen y oxidan a otras sustancias.
Agentes reductores: son especies químicas que pierden electrones, se oxidan y reducen a otras sustancias.
Reglas para asignar el número de oxidación: El uso de los números de oxidación parte del principio de que en toda fórmula química la suma algebraica de los números de oxidación debe ser igual a cero. Basado en esto se han creado las siguientes reglas:
Los elementos no combinados, en forma de átomos o moléculas tienen un número de oxidación igual a cero. Por ejemplo:
El hidrógeno en los compuestos de los cuales forma parte, tiene como número de oxidación +1:
En los hidruros metálicos el número de oxidación es -1.
Cuando hay oxigeno presente en un compuesto o ion, el numero de oxidación es de
-2:En los peróxidos el numero de oxidación del oxigeno es -1: H2O2-1
El oxigeno tiene numero de oxidación +2 en el F2O porque el F es mas electronegativo que el oxigeno.
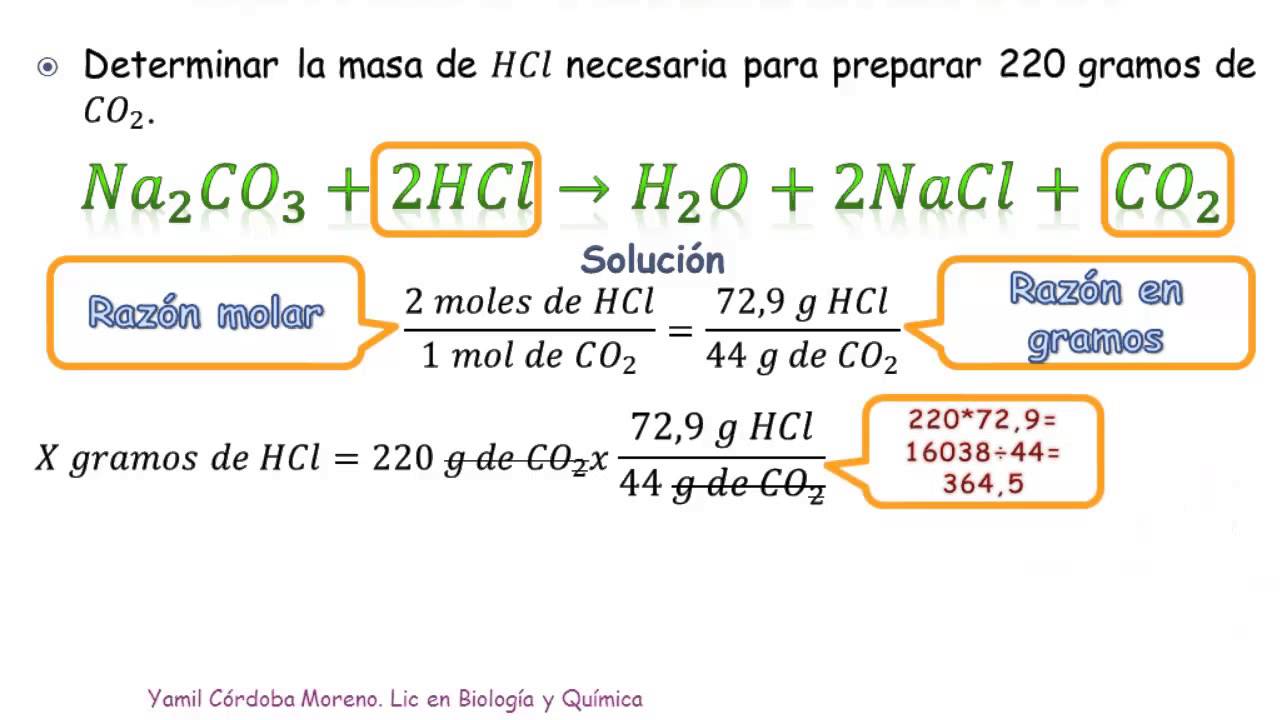
estequiometria
se produce cuando hay una modificación en la identidad química de las sustancias intervinientes; esto significa que no es posible identificar a las mismas sustancias antes y después de producirse la reacción química, los reactivos se consumen para dar lugar a los productos.

A escala microscópica una reacción química se produce por la colisión de las partículas que intervienen ya sean moléculas, átomos o iones, aunque puede producirse también por el choque de algunos átomos o moléculas con otros tipos de partículas, tales como electrones o fotones. Este choque provoca que las uniones que existían previamente entre los átomos se rompan y se facilite que se formen nuevas uniones. Es decir que, a escala atómica, es un reordenamiento de los enlaces entre los átomos que intervienen. Este reordenamiento se produce por desplazamientos de electrones: unos enlaces se rompen y otros se forman, sin embargo los átomos implicados no desaparecen, ni se crean nuevos átomos. Esto es lo que se conoce como ley de conservación de la masa, e implica los dos principios siguientes:
El número total de átomos antes y después de la reacción química no cambia.
El número de átomos de cada tipo es igual antes y después de la reacción.
En el transcurso de las reacciones químicas las partículas subatómicas tampoco desaparecen, el número total de protones, neutrones y electrones permanece constante. Y como los protones tienen carga positiva y los electrones tienen carga negativa, la suma total de cargas no se modifica. Esto es especialmente importante tenerlo en cuenta para el caso de los electrones, ya que es posible que durante el transcurso de una reacción química salten de un átomo a otro o de una molécula a otra, pero el número total de electrones permanece constante. Esto que es una consecuencia natural de la ley de conservación de la masa se denomina ley de conservación de la carga e implica que:
La suma total de cargas antes y después de la reacción química permanece constante.
Las relaciones entre las cantidades de reactivos consumidos y productos formados dependen directamente de estas leyes de conservación, y por lo tanto pueden ser determinadas por una ecuación (igualdad matemática) que las describa. A esta igualdad se le llama ecuación estequiométrica.
DEBE HABER UN ORDEN Y FALTO PANTALLAZOS DE LA PARTE EXPERIMENTAL 3.5
ResponderBorrar